Massa molecolare
Che cos’è la massa molecolare? E che cosa significa che può essere assoluta o relativa?
Per rispondere a queste domande, occorre innanzitutto dire che i concetti di massa atomica assoluta e massa atomica relativa possono essere applicati anche alle molecole. Anche nel loro caso esiste infatti sia una massa assoluta sia una massa relativa.
La massa molecolare (nota anche come massa molecolare assoluta) è la massa di una molecola espressa in grammi o in chilogrammi ed è data dalla somma delle masse atomiche di tutti gli atomi che la compongono.
Se prendessimo ad esempio una molecola di cloruro di sodio (NaCl), che è formata da un atomo di sodio e da un atomo di cloro, dovremmo sommare la massa atomica del sodio e la massa atomica del cloro:
m_m=(3,818\ ·{10}^{-23}\ g)+(5,887\ ·{10}^{-23}\ g)=9,705\ ·{10}^{-23}\ gLa massa molecolare relativa (MM), nota anche come peso molecolare (PM), si ottiene sommando le masse atomiche relative di tutti gli atomi che compongono la molecola.
Se ad esempio prendessimo una molecola d’acqua (H2O), che è formata da due atomi di idrogeno e un atomo di ossigeno, la sua MM sarebbe:
MM=1+1+16 =18\ u
Se una molecola è monoatomica, cioè è formata da un solo atomo, la sua MM è uguale alla massa atomica relativa dell’atomo (come ad esempio nel caso dell’elio).
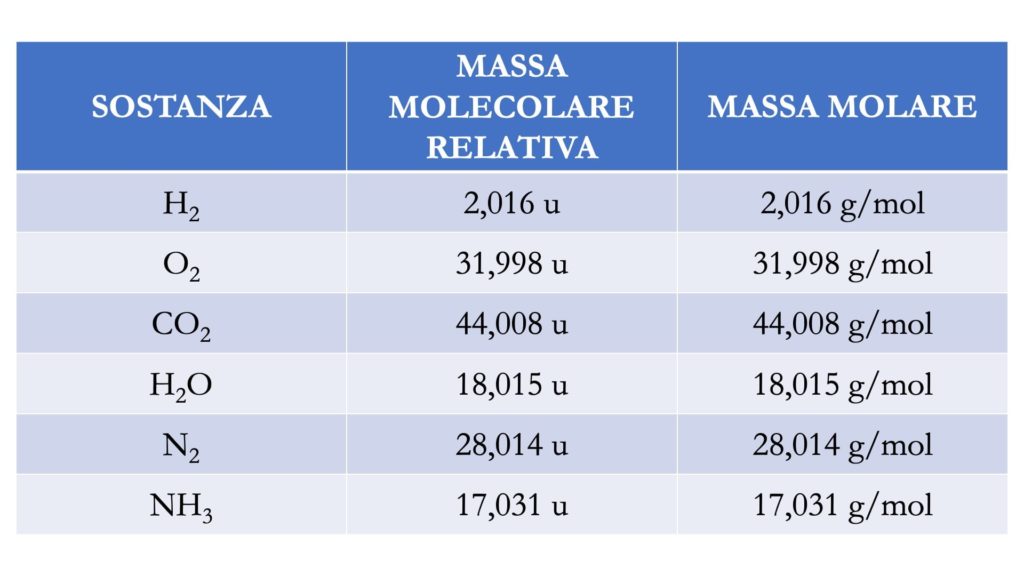
Massa atomica relativa, massa molecolare relativa e massa molare
La massa di una mole si chiama massa molare (M).
La massa molare di una sostanza è uguale alla sua massa atomica relativa o alla sua massa molecolare relativa (a seconda che la sostanza sia formata da atomi o da molecole) ed è espressa in g/mol.
Ad esempio, il monossido di carbonio (formula chimica CO) ha una MM di 28, per cui la sua massa molare è 28 g/mol.