Gli ossidi (caratteristiche e nomenclatura)
Gli ossidi sono composti binari in cui un elemento è combinato con l’ossigeno:
- se l’elemento è un metallo, siamo in presenza di un ossido basico
- se l’elemento è un non metallo, siamo in presenza di un ossido acido
Nella formula chimica di un ossido viene sempre messo prima il metallo o il non metallo e poi l’ossigeno (come avviene ad esempio in CO2).
I nomi degli ossidi
A seconda che si utilizzi la nomenclatura tradizionale o la nomenclatura IUPAC, gli ossidi vengono denominati in questo modo:
| Nomenclatura tradizionale |
| Ossido basico | = | “Ossido di…” / “Ossido…” |
| Ossido acido | = | “Anidride…” |
| Nomenclatura IUPAC |
| Ossido (sia basico sia acido) | = | “Ossido di…” |
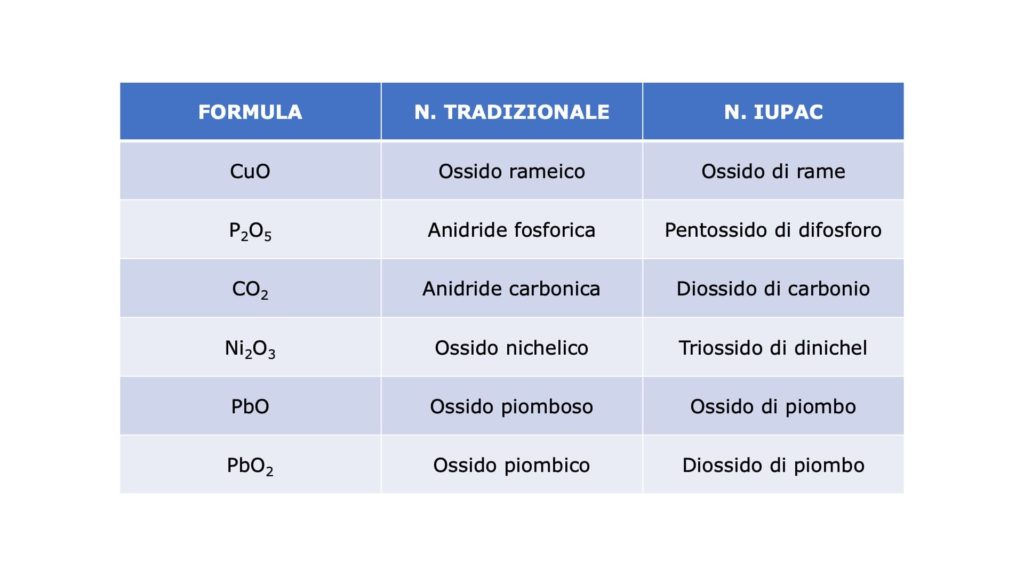
Nomenclatura tradizionale degli ossidi
Per gli ossidi basici:
- se il metallo presenta un solo numero di ossidazione, usiamo l’espressione ossido di seguita dal nome del metallo
- se il metallo presenta due numeri di ossidazione, usiamo l’espressione ossido di seguita dalla radice del nome del metallo con la desinenza -oso (se il metallo presenta il minore dei due numeri di ossidazione) o -ico (se il metallo presenta il maggiore dei due numeri di ossidazione)
Ad esempio:
- il calcio ha un solo numero di ossidazione (+2), per cui l’ossido che deriva da questo metallo prende il nome di ossido di calcio (CaO)
- il ferro ha due numeri di ossidazione (+ 2 e +3), per cui l’ossido che deriva dal ferro con numero di ossidazione +2 prende il nome di ossido ferroso (FeO), mentre l’ossido che deriva dal ferro con numero di ossidazione +3 prende il nome di ossido ferrico (Fe2O3)
Per gli ossidi acidi usiamo il termine anidride seguito dalla radice del nome del metallo con la desinenza -osa (se il metallo presenta il minore dei due numeri di ossidazione) o -ica (se il metallo presenta il maggiore dei due numeri di ossidazione).
Ad esempio, lo zolfo ha due numeri di ossidazione (+4 e +6). Pertanto, l’anidride che deriva dallo zolfo con numero di ossidazione +4 prende il nome di anidride solforosa (SO2), mentre l’anidride che deriva dallo zolfo con numero di ossidazione +6 prende il nome di anidride solforica (SO3).
Se il non metallo dell’ossido acido ha più di due numeri di ossidazione, usiamo:
- il prefisso ipo- e la desinenza -osa per l’anidride che deriva dal non metallo con il numero di ossidazione più basso
- il suffisso -osa per l’anidride che deriva dal non metallo con il numero di ossidazione intermedio inferiore
- il suffisso -ica per l’anidride che deriva dal non metallo con il numero di ossidazione intermedio superiore
- il prefisso per- e la desinenza -ica per l’anidride che deriva dal non metallo con il numero di ossidazione più alto
Ad esempio, il cloro ha quattro numeri di ossidazione (+1, +3, +5 e +7), per cui l’anidride che deriva da questo non metallo prende il nome rispettivamente di:
- anidride ipoclorosa (Cl2O)
- anidride clorosa (Cl2O3)
- anidride clorica (Cl2O5)
- anidride perclorica (Cl2O7)
Se il non metallo ha tre numeri di ossidazione invece di quattro, seguiamo lo stesso schema eliminando la prima opzione.
Nomenclatura IUPAC degli ossidi
Sia per gli ossidi basici sia per gli ossidi acidi usiamo l’espressione ossido di seguita dal nome del metallo o del non metallo.
Ad esempio, il composto FeO prende il nome di ossido di ferro.
Se un elemento presenta più atomi, usiamo i seguenti prefissi:
| 2 | Di- |
| 3 | Tri- |
| 4 | Tetra- |
| 5 | Penta- |
| 6 | Esa- |
| 7 | Epta- |
| 8 | Otta- |
| 9 | Nona- |
| 10 | Deca- |
Ad esempio, il composto Fe2O3 prende il nome di triossido di diferro, dato che ci sono due atomi di ferro e tre atomi di ossigeno.
Se c’è un solo atomo di ossigeno, viene talvolta aggiunto il prefisso mono- (ad esempio, CO è il monossido di carbonio).
I perossidi
Gli ossidi che contengono due atomi di ossigeno legati tra loro da un legame covalente puro si chiamano perossidi.
Per la denominazione di questi composti usiamo l’espressione perossido di seguita dal nome del metallo o del non metallo. Ciò vale sia per la nomenclatura tradizionale sia per la nomenclatura IUPAC (in quest’ultimo caso non aggiungiamo alcun prefisso).
Ad esempio, il composto Na2O2 prende il nome di perossido di sodio.
