I sali (caratteristiche e nomenclatura)
I sali sono composti ionici che si formano in seguito a una reazione in cui gli atomi di idrogeno di un idracido o di un ossiacido vengono sostituiti dagli atomi di un metallo.
Se vengono sostituiti tutti gli atomi di idrogeno, si parla di sali neutri. Se invece rimangono uno o più atomi di idrogeno, si parla di sali acidi (o idrogenosali).
Sali binari e sali ternari
A seconda che si formino a partire da un idracido o da un ossiacido, i sali possono essere:
- binari, cioè composti da due elementi, se si formano da un idracido
- ternari, cioè composti da tre elementi, se si formano da un ossiacido
Un sale binario è composto da un metallo e da un non metallo, mentre un sale ternario è formato da un non metallo, idrogeno e ossigeno.
Vediamo due esempi:
NaOH + HCl → NaCl + H2O
Mg(OH)2 + H2SO3 → MgSO3 + H2O
Nel primo caso l’idrossido di sodio reagisce con l’acido cloridrico (un idracido) e forma cloruro di sodio (un sale binario) e acqua. L’idrogeno H viene quindi sostituito dal sodio Na.
Nel secondo caso l’idrossido di magnesio reagisce con l’acido solforoso (un ossiacido) e forma solfito di magnesio (un sale ternario) e acqua. L’idrogeno H viene quindi sostituito dal magnesio Mg.
Come possiamo notare, in reazioni di questo tipo si formano sia un sale sia acqua.
I nomi dei sali
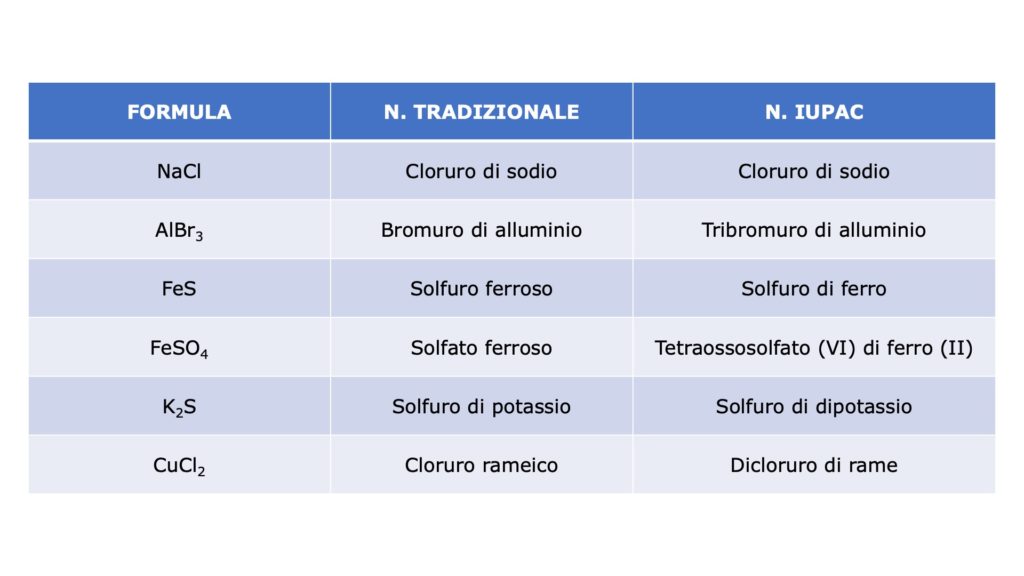
A seconda che si utilizzi la nomenclatura tradizionale o la nomenclatura IUPAC, i sali vengono denominati in questo modo:
Nomenclatura tradizionale
Bisogna guardare la radice del nome dell’idracido o dell’ossiacido da cui deriva il sale:
- se termina in -oso, le attacchiamo il suffisso -ito
- se termina in -ico, le attacchiamo il suffisso -ato
- se termina in -idrico, le attacchiamo il suffisso -uro
A questo punto mettiamo di, dopodiché aggiungiamo:
- il nome del metallo che prende il posto dell’idrogeno, se il metallo ha un solo numero di ossidazione
- la radice del nome del metallo che prende il posto dell’idrogeno, se il metallo ha due numeri di ossidazione, attaccandole poi il suffisso -oso (numero di ossidazione minore) o -ico (numero di ossidazione maggiore)
Facciamo un esempio pratico con il sale che deriva dall’acido solforoso (un ossiacido).
Per prima cosa prendiamo la radice solf- e le attacchiamo il suffisso -ito, dato che nell’ossiacido abbiamo il suffisso -oso. Poi aggiungiamo di, ottenendo così “solfito di”. Infine, aggiungiamo il nome del metallo che sostituisce l’idrogeno, cioè il sodio.
Il nome del sale è quindi solfito di sodio (Na2SO3).
E se il metallo, a differenza del sodio, avesse due numeri di ossidazione invece di uno? Facciamo un esempio con il ferro, che ha come numeri di ossidazione +2 e +3:
- dall’acido solforico che si combina con il ferro con numero di ossidazione +2 deriva il solfato ferroso (alla radice “ferr-” aggiungiamo quindi il suffisso “-oso”)
- dall’acido solforico che si combina con il ferro con numero di ossidazione +3 deriva il solfato ferrico (alla radice “ferr-” aggiungiamo quindi il suffisso “-ico”)
Per i sali acidi valgono le stesse regole, ma bisogna inserire “monoacido”, “biacido”, “triacido” e così via all’interno del nome in base al numero di atomi di idrogeno rimasti nel composto.
Ad esempio, il sale acido che ha formula chimica NaHCO3 prende il nome di carbonato monoacido di sodio (e infatti c’è un solo atomo di idrogeno).
Nomenclatura IUPAC
Per i sali binari (cioè che derivano da un idracido):
- prendiamo la radice del nome del non metallo presente nell’idracido e le attacchiamo il suffisso -uro
- mettiamo di
- aggiungiamo il nome del metallo che prende il posto dell’idrogeno
Facciamo un esempio con il sale che deriva dall’acido fluoridrico (idracido) e dal sodio (metallo):
- attacchiamo alla radice “fluor-” il suffisso “-uro”, ottenendo così fluoruro
- mettiamo di
- aggiungiamo sodio
Il nome del sale che si forma è fluoruro di sodio (NaF).
Se un elemento presenta più atomi, usiamo i seguenti prefissi:
| 2 | Di- |
| 3 | Tri- |
| 4 | Tetra- |
| 5 | Penta- |
| 6 | Esa- |
| 7 | Epta- |
| 8 | Otta- |
| 9 | Nona- |
| 10 | Deca- |
Ad esempio, il composto FeBr3 prende il nome di tribromuro di ferro, dato che ci sono tre atomi di bromo.
Per i sali ternari (cioè che derivano da un ossiacido):
- prendiamo il nome IUPAC dell’ossiacido e togliamo “acido”
- attacchiamo alla radice del nome del non metallo il suffisso -ato
- mettiamo di
- aggiungiamo il nome del metallo che prende il posto dell’idrogeno
- scriviamo tra parentesi in cifre romane il numero di ossidazione del metallo, se ne ha più di uno (quello del non metallo è già presente nel nome IUPAC dell’ossiacido)
Facciamo un esempio pratico con il sale che deriva dall’acido tetraossosolforico (VI), conosciuto anche come acido solforico nella nomenclatura tradizionale, e dal ferro:
- prendiamo “acido tetraossosolforico VI” e togliamo “acido”, ottenendo così tetraossosolforico (VI)
- attacchiamo alla radice “solf-” il suffisso “-ato”, ottenendo così tetraossosolfato (VI)
- mettiamo di
- aggiungiamo ferro
- scriviamo (II), cioè il numero di ossidazione del ferro, che in questo caso è +2
Il nome del sale che si forma è tetraossosolfato (VI) di ferro (II) e ha come formula chimica FeSO4. I numeri romani tra parentesi si leggono come dei normali numeri cardinali (in questo caso “sei” e “due”).
Se al posto del nome IUPAC dell’ossiacido di partenza avessimo la formula chimica del sale, ci basterebbe seguire questo schema:
- prefisso che indica il numero di atomi di ossigeno
- “osso”
- radice del nome del non metallo presente nell’ossiacido
- suffisso “ato”
- numero di ossidazione del non metallo in cifre romane tra parentesi (solo se ne ha più di uno)
- “di”
- nome del metallo che prende il posto dell’idrogeno
- numero di ossidazione del metallo in cifre romane tra parentesi (solo se ne ha più di uno)
Ad esempio, FeSO4 diventerebbe:
- “tetra”
- “osso”
- “solf”
- “ato”
- (VI)
- “di”
- “ferro”
- (II)
Attenzione
Le formula chimica dei sali segue queste regole:
- nei sali che derivano da un idracido viene sempre messo prima il metallo e poi il non metallo (NaCl)
- nei sali che derivano da un ossiacido viene sempre messo prima il metallo, poi il non metallo e infine l’ossigeno (MgSO3)
- nei sali acidi si scrive il metallo, l’idrogeno, il non metallo e infine l’ossigeno (NaHSO4)
È importante ricordarsi inoltre che i sali, se vengono messi in acqua e sono solubili, si dissociano negli ioni di partenza.
