Composti ionici
I composti ionici sono composti formati da ioni.
Cerchiamo di capire meglio questa definizione facendo una breve premessa.
Quando due atomi che hanno un’elettronegatività molto diversa si legano tra loro, l’atomo più elettronegativo sottrae uno o più elettroni all’atomo meno elettronegativo. Così facendo, l’atomo che acquista elettroni diventa uno ione con carica negativa (anione), mentre l’atomo che cede elettroni diventa uno ione con carica positiva (catione).
Un composto fatto di ioni invece che di normali atomi è un composto ionico. Un esempio è il cloruro di sodio (formula chimica NaCl), cioè il comune sale da cucina.
Il legame che tiene uniti gli ioni del composto si chiama legame ionico.
Struttura dei composti ionici
Allo stato solido i composti ionici formano un reticolo cristallino, in cui gli ioni sono disposti secondo una struttura ordinata e ripetitiva:
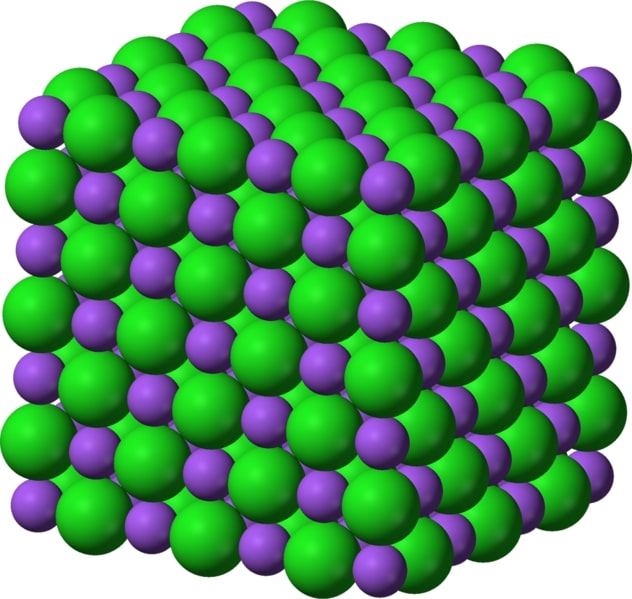
Mentre nei composti covalenti la formula chimica indica la composizione delle molecole, nei composti ionici, non essendoci molecole, la formula chimica indica la proporzione tra gli ioni positivi e gli ioni negativi all’interno di tale reticolo.
Ad esempio, la formula NaCl ci dice che nel cloruro di sodio c’è uno ione di sodio (Na+) per ogni ione di cloro (Cl–).
In altre parole, la formula chimica dei composti ionici corrisponde alla loro formula minima.
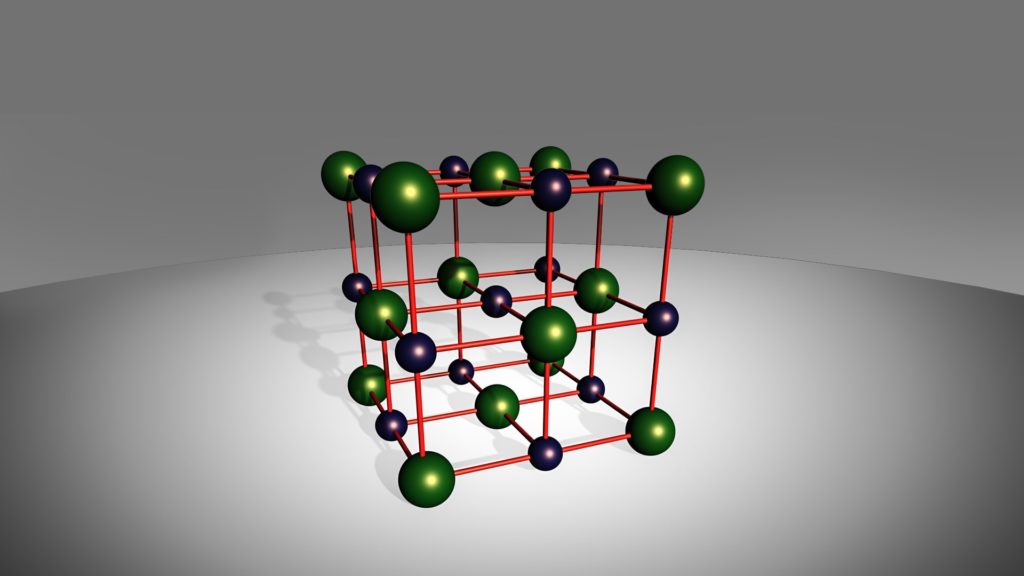
Il numero di ioni che circondano a uguale distanza un singolo ione di carica opposta è chiamato numero di coordinazione.
Ad esempio, il numero di coordinazione del cloruro di sodio è 6, dato che ogni ione di sodio è circondato da 6 ioni di cloro.
Il numero di coordinazione non può mai essere superiore a 12.
Tipologie e proprietà dei composti ionici
I composti ionici comprendono:
Le proprietà tipiche dei composti ionici sono le seguenti:
- hanno in genere un’alta temperatura di fusione
- sono solidi a temperatura ambiente
- alcuni non sono completamente solubili in acqua
- sono buoni conduttori di elettricità sia allo stato fuso (cioè quando sono passati allo stato liquido tramite fusione) sia in soluzione, ma non allo stato solido
- sono duri, ma fragili
Attenzione
Dato che i composti ionici non sono formati da molecole, nel loro caso il concetto di peso molecolare è sostituito dal concetto di peso formula.
Il peso formula si ottiene sommando le masse atomiche relative degli atomi che costituiscono la formula del composto ionico.
Come il peso molecolare, anche il peso formula si esprime in unità di massa atomica.
