La legge di Dalton (proporzioni multiple)
La legge di Dalton, nota anche come legge delle proporzioni multiple, dice che, quando un elemento si combina con la stessa massa di un altro elemento per formare composti diversi, le masse del primo elemento stanno tra loro in rapporti semplici ed esprimibili attraverso numeri interi e piccoli.
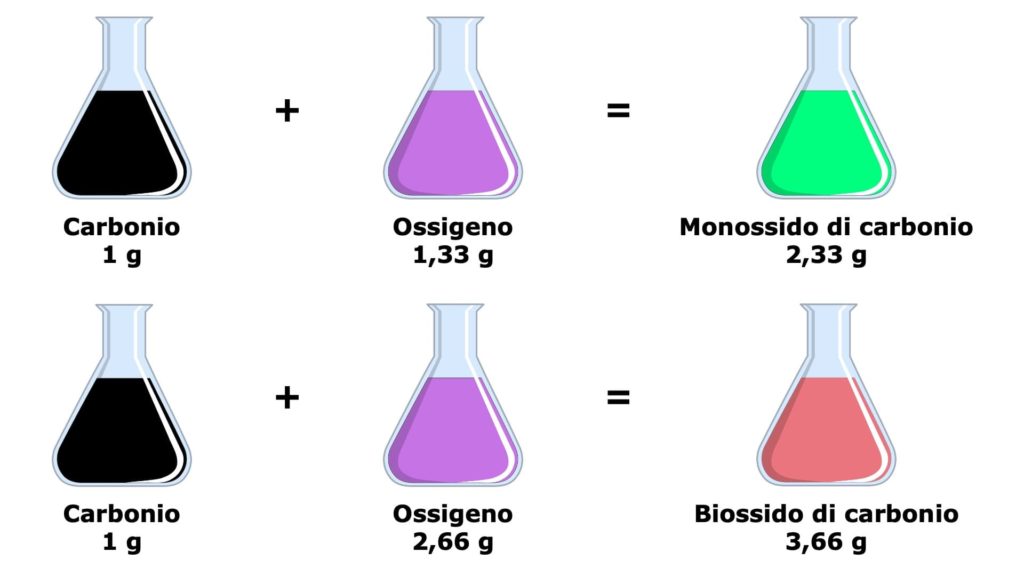
Cerchiamo di capire meglio questa legge con un esempio pratico. Se combiniamo insieme il carbonio e l’ossigeno, possiamo formare o il monossido di carbonio o il diossido di carbonio, cioè due composti diversi.
Nel monossido di carbonio ci sono 1,33 grammi di ossigeno per ogni grammo di carbonio, mentre nel diossido di carbonio ci sono 2,66 grammi di ossigeno per ogni grammo di carbonio.
Come possiamo notare, a un’identica massa di carbonio corrispondono due diverse masse di ossigeno (ed è questo diverso rapporto di combinazione tra l’ossigeno e il carbonio a determinare la formazione di un composto invece che dell’altro). Inoltre, il rapporto tra le due masse di ossigeno è di 1 : 2, in quanto una è il doppio dell’altra.
Rileggiamo la legge di Dalton
Proviamo allora a rileggere la legge di Dalton inserendo i dati dell’esempio appena visto.
Quando un elemento (ossigeno) si combina con la stessa massa di un secondo elemento (1 g di carbonio) per formare diversi composti (monossido di carbonio e diossido di carbonio), le masse del primo elemento (1,33 g di ossigeno e 2,66 g di ossigeno) stanno tra loro in rapporti esprimibili attraverso numeri interi e piccoli (1 : 2).
