La legge di Charles (legge isobara)
La legge di Charles (nota anche come prima legge di Gay Lussac o legge isobara) dice che, a pressione costante, il rapporto tra il volume e la temperatura assoluta di un gas è costante:
\frac{V}{T}=kPer capire bene questa legge, immaginiamo di avere un gas con un volume di 15 L e una temperatura di 300 K (la temperatura assoluta viene infatti espressa in Kelvin e non in gradi Celsius). Se scaldiamo il gas e raddoppiamo la sua temperatura, il suo volume raddoppia. Se lo scaldiamo ulteriormente e triplichiamo la sua temperatura, il suo volume triplica; e così via. In altre parole, l’aumento della temperatura è direttamente proporzionale all’aumento del volume, per cui il loro rapporto rimane sempre uguale:
\frac{15}{300}=0,05\frac{30}{600}=0,05\frac{45}{900}=0,05Perché ciò avvenga, è necessario che la pressione rimanga costante (ecco perché la legge è chiamata anche “isobara”). Inoltre, il gas non deve essere troppo compresso e la sua temperatura deve essere lontana dalla temperatura di liquefazione.
Che cosa succede alle particelle del gas?
Per capire come mai il volume sia direttamente proporzionale alla temperatura, dobbiamo osservare da vicino le particelle del gas. Infatti, in base alla teoria cinetico-molecolare sappiamo che il comportamento macroscopico di un gas dipende dal suo comportamento microscopico (cioè che la temperatura, la pressione e il volume di un gas sono variabili legate al comportamento delle sue particelle).
Quando il gas ha un certo volume (V1) e una certa temperatura (T1), le sue particelle urtano le pareti del recipiente circostante con una certa frequenza. Se raddoppiamo la temperatura (T2), la frequenza degli urti raddoppia. A questo punto, se la pressione non cambia (cioè se la frequenza degli urti rimane la stessa), è inevitabile che raddoppi anche il volume (V2), in modo che le particelle abbiano più spazio per muoversi e urtino quindi le pareti del recipiente con la stessa frequenza di prima. Ecco spiegato perché il volume e la temperatura di un gas sono direttamente proporzionali.
La seguente immagine può aiutare a capire meglio ciò che avviene a livello microscopico:
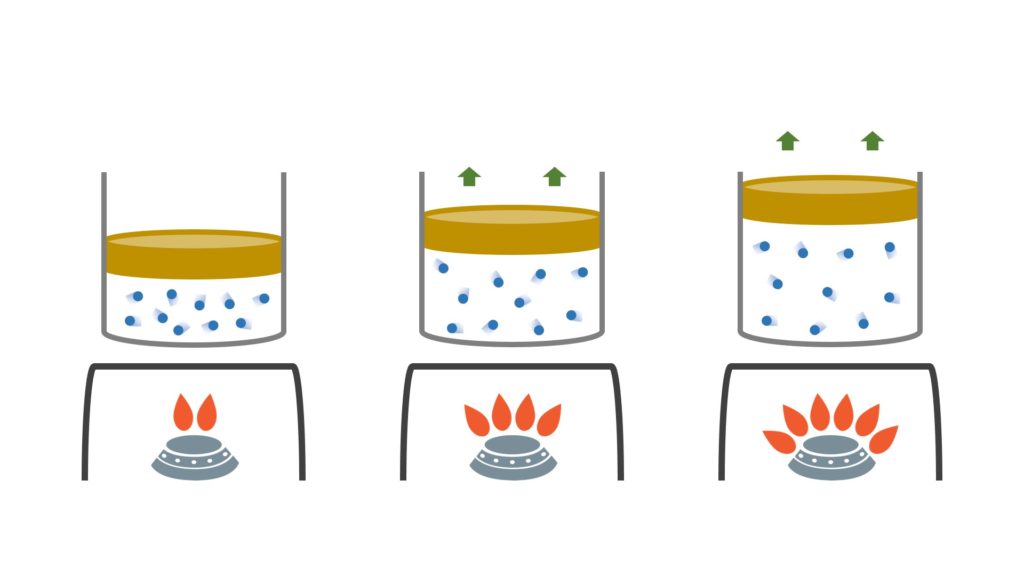
A mano a mano che scaldiamo il gas all’interno del recipiente, le particelle si muovono a velocità sempre maggiore. Pertanto, il gas si espande e spinge quindi verso l’alto il coperchietto.
Se però tenessimo premuto il coperchietto con un dito (cioè se facessimo aumentare la pressione del gas), il volume non aumenterebbe, perché le particelle continuerebbero a muoversi nello stesso spazio di prima, sebbene più velocemente.
Rappresentazione grafica
Questa correlazione tra la temperatura e il volume di un gas corrisponde graficamente a una retta passante per l’origine:
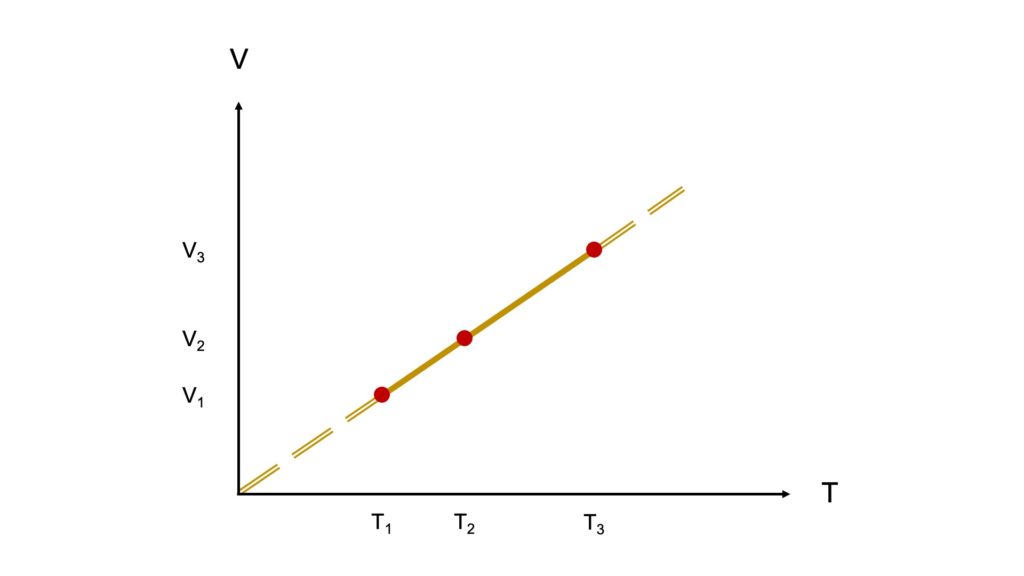
Come possiamo notare, all’aumentare della temperatura si verifica un aumento del volume (e viceversa). Ciò vale per tutti i gas, dato che la legge di Charles è una delle leggi dei gas ed è quindi applicabile a tutti i gas (assumendo che i gas si comportino come un gas ideale).
Facciamo un esempio pratico usando i seguenti valori:
| V1 | = | 12 L |
| T1 | = | 300 K |
| V2 | = | 12,8 L |
| T2 | = | 320 K |
| V3 | = | 14 L |
| T3 | = | 350 K |
In tutti questi casi il rapporto tra volume e temperatura, che aumentano proporzionalmente, rimane sempre uguale. Possiamo pertanto scrivere:
\frac{V_1}{T_1}=\frac{V_2}{T_2}=\frac{V_3}{T_3}=kE quindi:
\frac{12}{300}=\frac{12,8}{320}=\frac{14}{350}=0,04Rapporto tra volume e temperatura in gradi Celsius
Come abbiamo visto, la legge di Charles stabilisce una correlazione tra il volume di un gas e la sua temperatura assoluta. Questa correlazione non funziona tuttavia in maniera analoga con la temperatura in gradi Celsius, il cui aumento non comporta un aumento direttamente proporzionale del volume.
Se ad esempio passassimo da 30° (= 303 K) a 60° (= 333 K), cioè se la temperatura in gradi Celsius raddoppiasse, non raddoppierebbe anche il volume, perché non ci sarebbe un raddoppiamento della temperatura assoluta, che passerebbe infatti da 303 K a 333 K.
Il rapporto tra il volume e la temperatura in gradi Celsius è basato sulla variazione di un singolo grado. A ogni aumento di 1° corrisponde infatti un aumento del volume pari a 1/273 del volume che il gas presenterebbe a 0° (ovviamente solo se la pressione rimane costante).
La formula che esprime tale rapporto è la seguente:
V_t=V_0\ ·(1+\alpha\ ·t)
Dove:
- Vt è il volume del gas a una determinata temperatura (°C)
- V0 è il volume del gas a 0°
- α è il coefficiente di espansione pari a 1/273
- t è la temperatura (°C)
La formula può quindi essere scritta anche in questo modo:
V_t=V_0+\frac{1}{273}\ ·V_0\ ·tQuesto rapporto tra volume e temperatura in gradi Celsius fu scoperto dal chimico Joseph Louis Gay-Lussac alcuni anni dopo che il chimico Jacques Charles aveva formulato la legge di cui abbiamo parlato prima (ecco perché la legge è conosciuta sia come legge di Charles sia come prima legge di Gay-Lussac).
Calcolare volume e temperatura con la legge di Charles
Se il volume (V1) e la temperatura (T1) di un gas a un certo punto cambiano, come facciamo a sapere quanto misura il suo nuovo volume (V2), conoscendo la sua nuova temperatura (T2) e presupponendo che la pressione rimanga costante? Per rispondere a questa domanda, è sufficiente fare una semplice proporzione:
V1 : T1 = V2 : T2
Ad esempio:
| V1 | = | 5 L |
| T1 | = | 400 K |
| V2 | = | x |
| T2 | = | 430 K |
A questo punto facciamo la proporzione:
5 : 400 = x : 430
Per cui:
x=\frac{5\ ·430}{400}=5,375\ LE se la temperatura fosse in gradi Celsius? In questo caso non dobbiamo fare altro che sommare ad essa 273,15:
20° = 293,15 K
In questo caso le cifre decimali di solito vengono approssimate (e quindi 293,15 diventerebbe ad esempio 293).
