Le proprietà dei gas
Quali sono le proprietà dei gas? Vediamolo insieme.
Tutti i gas che esistono in natura hanno in comune queste proprietà:
- si espandono facilmente, dato che le particelle hanno un’elevata energia cinetica e legami intermolecolari sono deboli
- non hanno né volume né forma propria, ma occupano tutto lo spazio libero a disposizione (assumendo quindi la forma del recipiente, se sono in uno spazio chiuso, o espandendosi in maniera informe, se sono in uno spazio aperto)
- hanno una densità inferiore a quella dei liquidi e dei solidi, dato che nei gas lo spazio vuoto tra le particelle è maggiore
- sono facilmente comprimibili
Il comportamento dei gas dipende da quattro fattori, cioè temperatura, volume, pressione e quantità.
Il modo in cui un gas si comporta al variare di queste grandezze è definito dalle seguenti leggi, note come leggi dei gas:
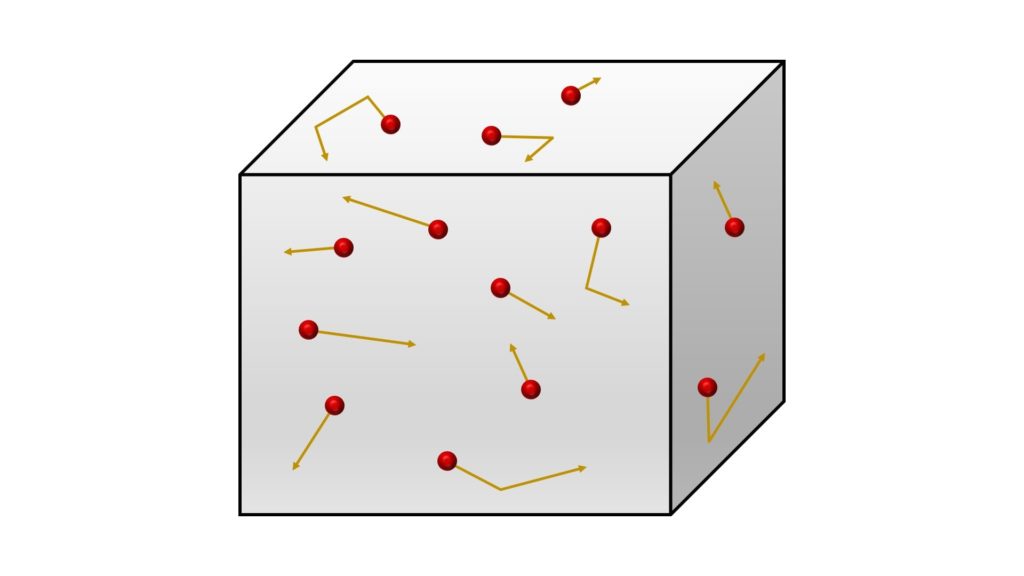
Queste leggi sono state formulate a partire dalla teoria cinetico-molecolare dei gas, un modello statistico che spiega il comportamento dei gas assumendo che essi si comportino come un gas ideale.
In base a questa teoria, i gas possono essere immaginati come sistemi formati da un numero elevatissimo di particelle che urtano continuamente le pareti del recipiente in cui si muovono: ciò significa che il comportamento macroscopico di un gas dipende dal movimento delle sue particelle.
Le proprietà dei gas: differenza tra gas e vapore
Anche se spesso vengono considerati uguali, è importante ricordarsi che il gas e il vapore non sono la stessa cosa:
- il gas è una sostanza aeriforme che si trova al di sopra della propria temperatura critica
- il vapore è una sostanza aeriforme che si trova al di sotto della propria temperatura critica
