Il reagente limitante
Che cos’è il reagente limitante? Vediamolo insieme.
Ogni volta che in una reazione chimica le quantità dei vari reagenti rispettano la giusta proporzione, i reagenti si trasformano del tutto (non rimane cioè alcuna traccia di essi, dopo che si sono trasformati nei prodotti).
Se però non c’è la giusta proporzione tra le loro quantità, che cosa succede? In questo caso un reagente si trasforma del tutto, mentre gli altri rimangono in parte come prima.
Facciamo un esempio pratico per capire bene questa cosa.
Se abbiamo sei fette di pane e tre fette di prosciutto, possiamo fare in tutto tre panini. Le fette di pane e le fette di prosciutto rappresentano i reagenti, mentre i panini rappresentano i prodotti. In questo caso c’è la giusta proporzione tra le quantità dei reagenti (e infatti non avanzano né fette di pane né fette di prosciutto):
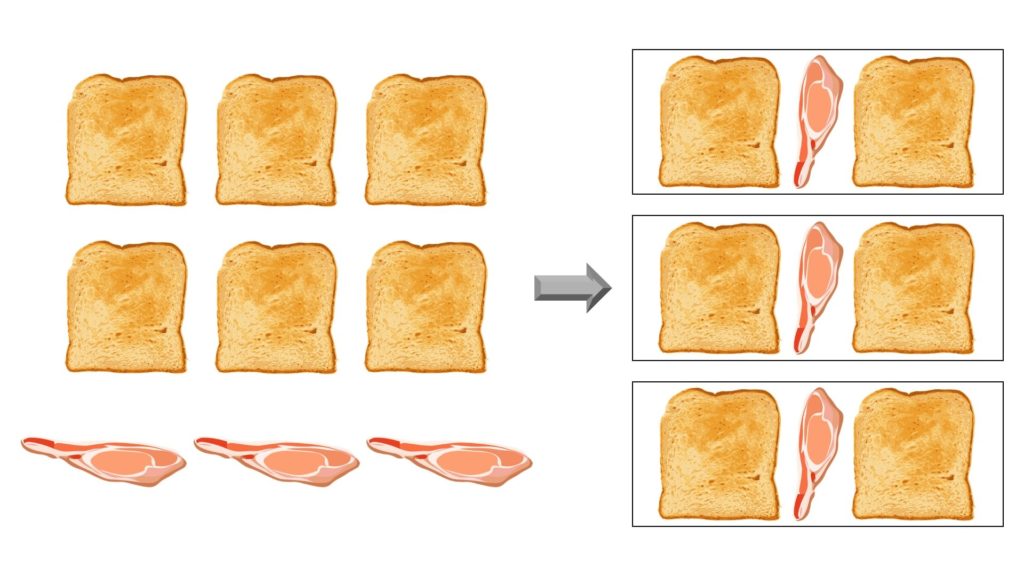
Se però avessimo due fette di prosciutto, riusciremmo a fare soltanto due panini e ci avanzerebbero due fette di pane. In questo caso un reagente (cioè il prosciutto) è stato usato per intero, mentre l’altro (cioè il pane) è rimasto in parte come prima:
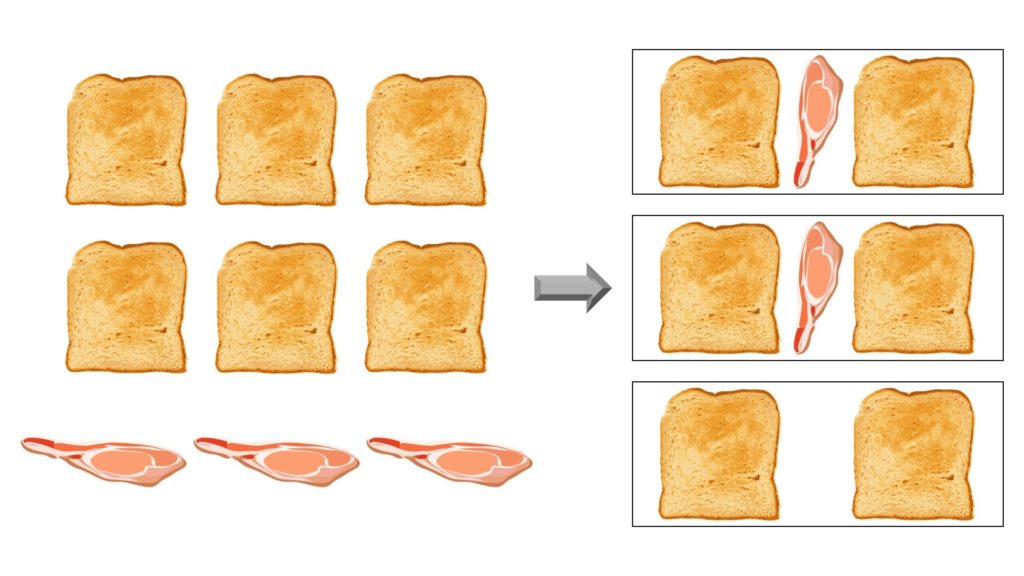
In una reazione chimica succede la stessa cosa. Se non c’è la giusta proporzione tra le quantità dei reagenti, uno di essi si trasforma del tutto, mentre gli altri rimangono in parte come prima.
Il reagente che si trasforma del tutto prende il nome di reagente limitante, mentre ogni reagente che rimane in parte come prima prende il nome di reagente in eccesso.
Il reagente limitante limita quindi la quantità di prodotto che può formarsi, perché, una volta che si è trasformato del tutto, impedisce che gli altri reagenti continuino a trasformarsi (ecco perché viene definito “limitante”).
Come individuare il reagente limitante
Cerchiamo ora di capire come distinguere il reagente limitante dai reagenti in eccesso in un’equazione chimica (cioè la rappresentazione in simboli di una reazione chimica):
N2 + 3H2 → 2NH3
Se facciamo reagire 4 moli di N2 e 11 moli di H2, qual è il reagente limitante?
Per individuare il reagente limitante, non dobbiamo fare altro che dividere le moli di ciascun reagente per il suo coefficiente stechiometrico. Il reagente con il risultato minore è il reagente limitante:
\frac{4}{1}=4\frac{11}{3}=3,7In questo caso il reagente limitante è H2.
L’equazione ci dice infatti che per ogni mole di N2 devono esserci tre moli di H2, altrimenti i reagenti non si trasformano del tutto. Dato che qui abbiamo 4 moli di N2, servirebbero 12 moli di H2, ma ce ne sono solo 11. Di conseguenza, H2 si trasforma del tutto, mentre N2 rimane in parte come prima, perché manca quella porzione di H2 con cui possa reagire (e quindi trasformarsi) l’ultima porzione di N2.
Se invece i risultati della divisione fossero uguali (ad esempio, 4 in entrambi i casi), significherebbe che c’è la giusta proporzione tra le quantità dei reagenti e che quindi i reagenti si trasformano del tutto.
Attenzione
Quando si parla di reagente limitante, non bisogna confondere le informazioni che ci forniscono i coefficienti stechiometrici con le informazioni che ci forniscono le moli dei reagenti.
Per riprendere l’esempio dei panini:
Quello che ci dicono i coefficienti stechiometrici
Per fare un panino, servono due fette di pane e una fetta di prosciutto.
Quello che ci dicono le moli
Abbiamo tre fette di pane e due fette di prosciutto.
I coefficienti stechiometrici rappresentano cioè la proporzione che i reagenti devono rispettare per trasformarsi del tutto, mentre le moli rappresentano le quantità dei vari reagenti.
