Reazioni di scambio semplice
Le reazioni di scambio semplice (o di spostamento) sono reazioni chimiche in cui un elemento reagisce con un composto e si scambia con uno degli elementi presenti nel composto.
L’equazione generale di tali reazioni è la seguente:
A + BC → AC + B
Ad esempio:
Zn + CuSO4 → ZnSO4 + Cu
Qui lo zinco reagisce con il solfato di rame e forma rame e solfato di zinco. In pratica, lo zinco prende il posto del rame nel composto.
I metalli nelle reazioni di scambio semplice
L’elemento libero è sempre un metallo e si scambia o con un altro metallo o con l’idrogeno.
Perché questo scambio avvenga, il metallo libero deve essere più reattivo del metallo o dell’idrogeno presente nel composto.
La scala di reattività dei metalli è la seguente:
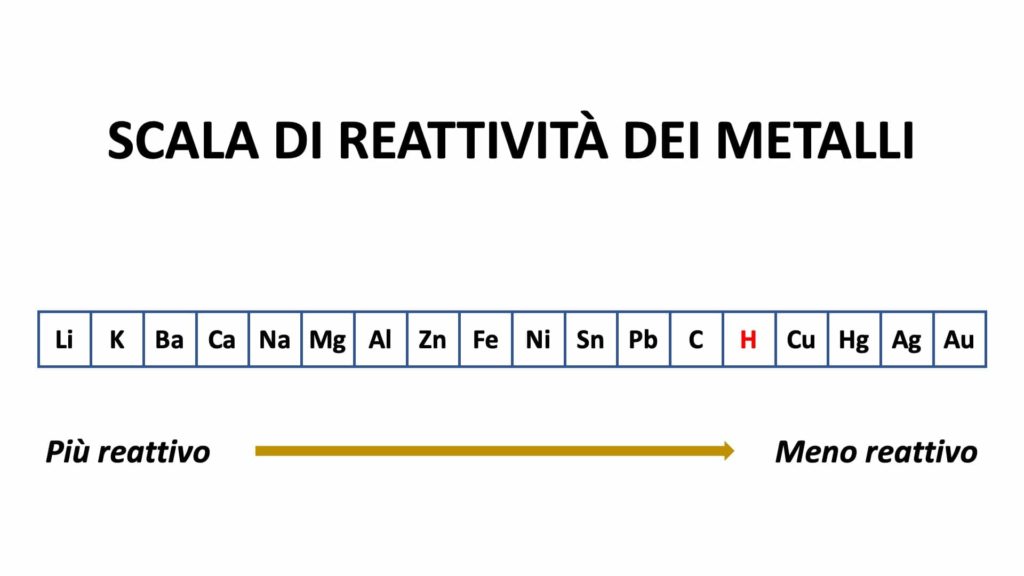
Ciò significa ad esempio che lo zinco può prendere il posto del rame, ma il rame non può prendere il posto dello zinco, dato che lo zinco è più reattivo di esso.
Tre diverse reazioni di scambio semplice
Le reazioni di scambio semplice funzionano in questo modo:
Un metallo e acqua formano un idrossido e idrogeno
2Na + 2H2O → 2NaOH + H2
Un metallo e un acido (cioè un idracido o un ossiacido) formano un sale e idrogeno
Ni + 2HCl → NiCl2 + H2
Un metallo e un sale formano un metallo e un sale
Li + NaCl → LiCl + Na
È importante ricordarsi inoltre che in una soluzione acquosa un metallo può spostare un altro metallo meno reattivo dal suo sale. In questo caso gli atomi del metallo più reattivo si trasformano in ioni positivi, mentre gli ioni positivi già presenti all’inizio nella soluzione diventano atomi neutri.
Facciamo un esempio usando di nuovo lo zinco e il rame, ma questa volta scriviamo la loro equazione ionica netta (cioè l’equazione che ci dice se le sostanze in soluzione acquosa siano composte o no da ioni):
Zn(s) + Cu2+(aq) + SO42-(aq) → Cu(s) + Zn2+(aq) + SO42-(aq)
Togliamo gli ioni spettatori (cioè gli ioni che si presentano con lo stesso coefficiente stechiometrico e con la stessa carica sia tra i reagenti sia tra i prodotti) e otteniamo:
Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq)
Come possiamo notare, gli atomi del metallo più reattivo (Zn) si sono trasformati in ioni positivi (Zn2+), mentre gli ioni positivi già presenti all’inizio (Cu2+) sono diventati atomi neutri (Cu).
Gli altri tipi di reazioni chimiche
Oltre che di scambio semplice, le reazioni chimiche possono essere:
