Le trasformazioni fisiche e chimiche
La materia è costantemente soggetta a trasformazioni. Pensiamo ad esempio all’acqua che congelandosi diventa ghiaccio o a un foglio che bruciando diventa cenere.
A seconda di come muta la materia, le sue trasformazioni possono essere di due tipi:
- trasformazioni fisiche
- trasformazioni chimiche
Le trasformazioni fisiche
Le trasformazioni fisiche modificano le proprietà fisiche della materia, lasciando però inalterata la sua composizione chimica.
Se ad esempio sciogliamo un cubetto di ghiaccio, l’acqua passa dallo stato solido allo stato liquido, ma continua ad essere acqua.
Quello che succede, in pratica, è che le sue molecole rimangono le stesse di prima, ma assumono una disposizione diversa:
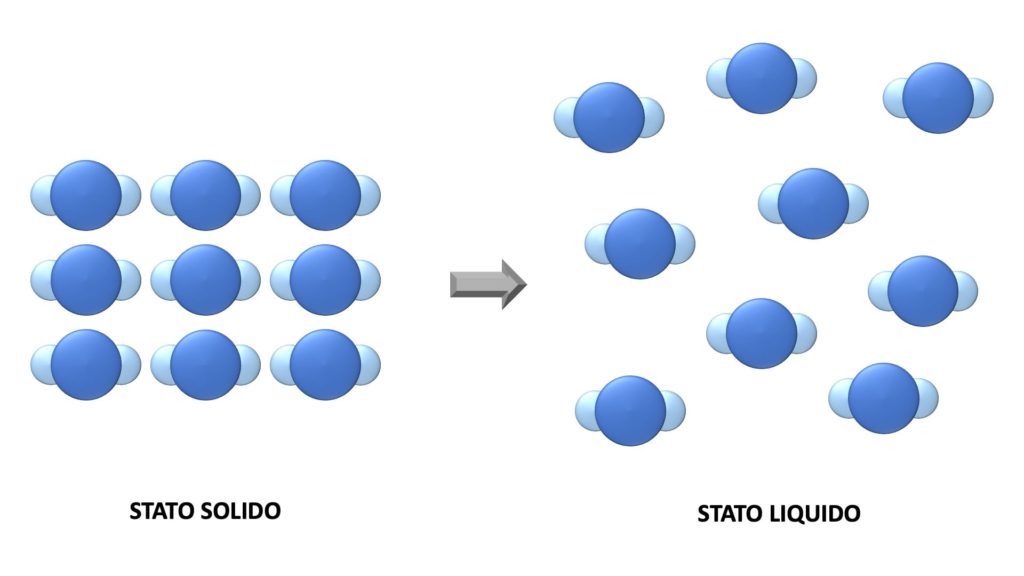
Le trasformazioni fisiche sono reversibili (cioè si può tornare allo stato di partenza attraverso un’altra trasformazione fisica) e non producono nuove sostanze.
Per riprendere l’esempio di prima, possiamo riportare l’acqua dallo stato liquido allo stato solido e in nessuno di questi casi si forma una sostanza diversa dall’acqua.
Il passaggio da un determinato stato a un altro prende il nome di passaggio di stato.
Le trasformazioni chimiche
Le trasformazioni chimiche, dette anche reazioni chimiche, modificano la composizione chimica della materia, portando alla formazione di nuove sostanze.
Se ad esempio il ferro viene a contatto con l’aria, la sua superficie si copre di ruggine, una sostanza che prima non c’era. Quello che succede, in pratica, è che le molecole di ferro si combinano con le molecole di ossigeno presenti nell’aria, formando così l’ossido di ferro (formula chimica Fe2O3):
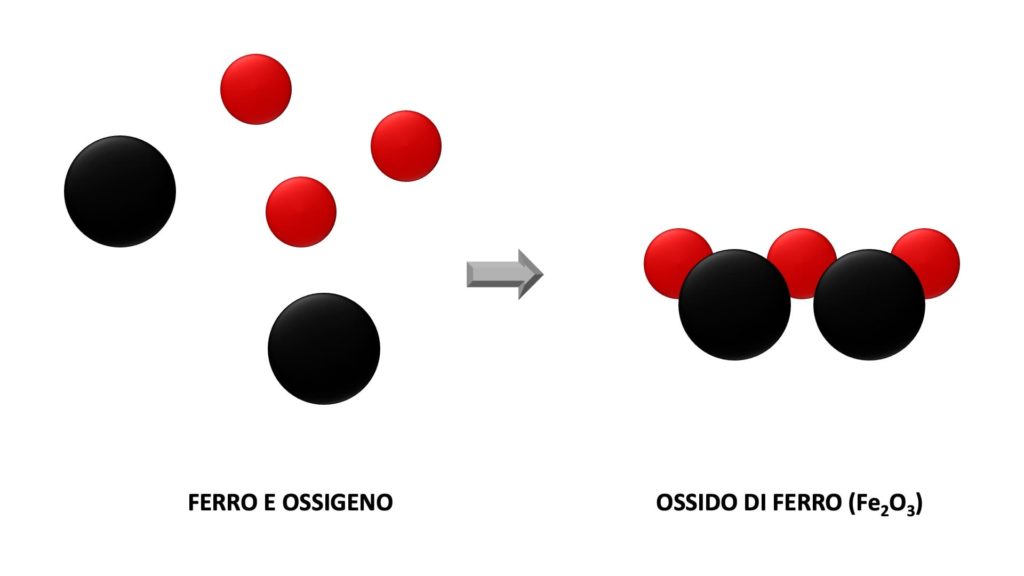
Nelle trasformazioni chimiche le sostanze di partenza sono chiamate reagenti, mentre le sostanze che si formano sono chiamate prodotti.
Le proprietà dei prodotti sono diverse rispetto alle proprietà dei singoli reagenti (ad esempio, l’ossido di ferro ha un colore rossastro che il ferro e l’ossigeno non hanno).
Le trasformazioni chimiche sono irreversibili (cioè non si può tornare alle sostanze di partenza attraverso una trasformazione fisica).
Per riprendere l’esempio di prima, non possiamo scomporre l’ossido di ferro in ossigeno e ferro, se non con un’altra trasformazione chimica.
Le trasformazioni chimiche vengono rappresentate in forma scritta attraverso un’equazione chimica:
C + O2 → CO2
A sinistra vengono scritte le formule chimiche dei reagenti, mentre a destra quelle dei prodotti.
Qui ad esempio un atomo di carbonio si combina con due atomi di ossigeno, formando così il diossido di carbonio.
Durante una trasformazione chimica si verificano di solito questi fenomeni:
- formazione di bollicine
- variazione di colore
- formazione o scomparsa di un solido
- liberazione di prodotti gassosi profumati o maleodoranti
- riscaldamento o raffreddamento del recipiente in cui avviene la reazione (senza che sia stato fornito o sottratto calore dall’esterno)
Esempi
Ecco alcuni esempi di trasformazioni fisiche:
- i passaggi di stato
- la dissoluzione dello zucchero o del sale in acqua
- la dilatazione di un metallo per il calore
- la magnetizzazione dell’ago di una bussola
Ecco invece alcuni esempi di trasformazioni chimiche:
- la combustione
- l’arrugginimento
- la lievitazione del pane
- la fermentazione alcolica
Dato che non sempre possiamo capire a prima vista se una trasformazione sia fisica o chimica, dobbiamo analizzare chimicamente la materia che si trasforma, in modo da vedere se si siano formate nuove sostanze (e in questo caso si tratta di una trasformazione chimica) oppure no (e in questo caso si tratta di una trasformazione fisica).
