Bilanciamento redox
Come si fa il bilanciamento di una reazione redox? Vediamolo insieme.
Le reazioni redox sono reazioni chimiche in cui avviene un trasferimento di elettroni da una specie chimica a un’altra.
Per bilanciare queste reazioni, dobbiamo fare in modo non soltanto che venga rispettata la legge di Lavoisier come nelle normali reazioni chimiche (cioè che ci sia lo stesso numero di atomi di ciascun elemento sia tra i reagenti sia tra i prodotti), ma anche che il numero degli elettroni acquistati dalla specie chimica che si riduce sia uguale al numero di elettroni ceduti dalla specie chimica che si ossida.
Il bilanciamento delle reazioni redox può essere fatto in due modi:
Bilanciamento redox: il metodo della variazione del numero di ossidazione
Il metodo della variazione del numero di ossidazione prevede i seguenti passaggi:
- assegnare il numero di ossidazione a tutte le specie chimiche presenti
- individuare le due specie chimiche in cui il numero di ossidazione cambia
- bilanciare le due specie chimiche
- calcolare il numero di elettroni acquistati e ceduti dalle due specie chimiche
- bilanciare gli elettroni acquistati e ceduti (cioè fare in modo che il numero di elettroni acquistati sia uguale al numero di elettroni ceduti)
- bilanciare tutte le altre specie chimiche
Facciamo un esempio pratico:
H2SO4 + NaI → NaIO3 + SO2 + H2O
Innanzitutto, assegniamo a ciascuna specie chimica il giusto numero di ossidazione (per farlo, basta seguire le regole per l’assegnazione del numero di ossidazione):
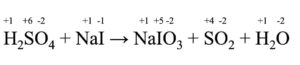
Come possiamo notare, le due specie chimiche in cui il n.o. cambia sono S e I:
- il n.o. di S passa da +6 a +4
- il n.o. di I passa da -1 a +5
Ricordiamoci che l’elemento in cui il n.o. aumenta è quello che si ossida (in questo caso S), mentre l’elemento in cui il n.o. diminuisce è quello che si riduce (in questo caso I).
A questo punto controlliamo il numero di atomi di S e di I e, se ce n’è bisogno, bilanciamo entrambe le specie chimiche con gli opportuni coefficienti stechiometrici.
Dato che sia S sia I hanno un atomo tra i reagenti e un atomo tra i prodotti, non dobbiamo fare alcuna aggiunta.
Adesso calcoliamo il numero di elettroni acquistati e ceduti.
Dato che per ogni elettrone acquistato il n.o. diminuisce di 1, mentre per ogni elettrone ceduto il n.o. aumenta di 1, sappiamo che:
- S ha acquistato 2 elettroni (da +6 è passato a +4)
- I ha ceduto 6 elettroni (da -1 è passato a +5)
Qualora una specie chimica abbia un indice diverso da 1, dobbiamo moltiplicare il suo n.o. per il suo indice. Se avessimo ad esempio S2 al posto di S, dovremmo moltiplicare +6 per 2 e +4 per 2, per cui il suo n.o. passerebbe da +12 tra i reagenti a +8 tra i prodotti.
Questa cosa va fatta anche in caso di coefficiente stechiometrico diverso da 1. Se avessimo ad esempio un 3 davanti alle specie chimiche che contengono S, dovremmo moltiplicare +6 per 3 e +4 per 3, per cui il suo n.o. passerebbe da +18 tra i reagenti a +12 tra i prodotti.
Terminato questo passaggio, bilanciamo il numero di elettroni acquistati e ceduti. Dato che in qualsiasi reazione redox il numero di elettroni acquistati è sempre uguale al numero di elettroni ceduti, dobbiamo fare in modo che S, che ha acquistato 2 elettroni, ne acquisti 6, cioè tanti quanti quelli ceduti da I.
Per farlo, riduciamo ai minimi termini 6 e 2, moltiplicando poi per ciascun risultato la specie chimica opposta:
\frac{6}{2}=3\frac{2}{2}=1Moltiplichiamo quindi per 3 le specie chimiche che contengono S e per 1 le specie chimiche che contengono I:
3H2SO4 + NaI → NaIO3 + 3SO2 + H2O
Così facendo, il n.o. di S diventa +18 (cioè + 6 moltiplicato per 3) tra i reagenti e +12 (cioè +4 moltiplicato per 3) tra i prodotti. Pertanto, gli elettroni acquistati da S diventano 6 (cioè 18-12).
A questo punto non ci rimane che bilanciare tutte le altre specie chimiche come in una normale reazione:
3H2SO4 + NaI → NaIO3 + 3SO2 + 3H2O
Bilanciamento redox: il metodo delle semireazioni
Il metodo delle semireazioni, chiamato anche metodo ionico-elettronico, è usato soprattutto per le reazioni redox che avvengono in soluzione acquosa.
Questo metodo prevede i seguenti passaggi:
- scrivere l’equazione in forma ionica
- assegnare il numero di ossidazione a tutte le specie chimiche presenti
- individuare le due specie chimiche in cui il numero di ossidazione cambia
- scrivere separatamente le due semireazioni (ossidazione e riduzione)
- bilanciare separatamente ciascuna semireazione (aggiungendo poi una molecola di H2O per ogni atomo di O e uno ione H+ per ogni atomo di H)
- calcolare il numero di elettroni acquistati e ceduti dalle due specie chimiche
- bilanciare le cariche delle due semireazioni
- bilanciare gli elettroni acquistati e ceduti (cioè fare in modo che il numero di elettroni acquistati sia uguale al numero di elettroni ceduti)
- unire le due semireazioni in un’unica equazione
- bilanciare tutte le altre specie chimiche
Facciamo un esempio pratico:
Cr2O7 + Fe → Cr + Fe
Innanzitutto, scriviamo l’equazione in forma ionica, così da mostrare in quali ioni si dissociano le sostanze presenti:
Cr2O72- + Fe2+ → Cr3+ + Fe3+
Adesso assegniamo a ciascuna specie chimica il giusto n.o. (anche qui basta seguire le regole per l’assegnazione del numero di ossidazione):
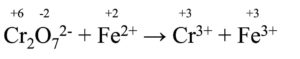
Come possiamo notare, le due specie chimiche in cui il n.o. cambia sono Cr e Fe:
- il n.o. di Cr passa da +6 a +3
- il n.o. di Fe passa da +2 a +3
A questo punto dividiamo la reazione complessiva in due semireazioni, cioè separiamo l’ossidazione dalla riduzione:
Riduzione
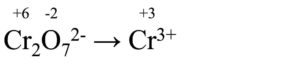
Ossidazione
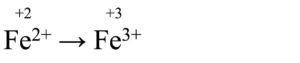
Ricordiamoci che l’elemento in cui il n.o. aumenta è quello che si ossida, mentre l’elemento in cui il n.o. diminuisce è quello che si riduce.
Adesso controlliamo il numero di atomi di queste specie chimiche e, se ce n’è bisogno, le bilanciamo con gli opportuni coefficienti stechiometrici.
L’ossidazione va già bene così, mentre per la riduzione dobbiamo fare un’aggiunta:
Cr2O72- → 2Cr3+
E per bilanciare O? Come facciamo, visto che non compare tra i prodotti? Per O (ossigeno) e per H (idrogeno) il bilanciamento funziona in questo modo:
- per ogni atomo di O mettiamo dall’altra parte della freccia una molecola di H2O
- per ogni atomo di H mettiamo dall’altra parte della freccia uno ione H+
Di conseguenza, dato che qui abbiamo 7 atomi di O, aggiungiamo 7 molecole di H2O:
Cr2O72- → 2Cr3+ + 7H2O
A questo punto, dato che ci ritroviamo con 14 atomi di H, dobbiamo aggiungere 14 ioni H+ (in altre parole, quando aggiungiamo molecole di H2O, dobbiamo ricordarci che stiamo inevitabilmente aggiungendo anche atomi di H, che devono quindi essere poi bilanciati con ioni H+):
Cr2O72- + 14H+ → 2Cr3+ + 7H2O
Adesso calcoliamo il numero di elettroni acquistati e ceduti nelle due semireazioni.
Dato che per ogni elettrone acquistato il n.o. diminuisce di 1, mentre per ogni elettrone ceduto il n.o. aumenta di 1, sappiamo che:
- Cr ha acquistato 6 elettroni (da +12 è passato a +6)
- Fe ha ceduto 1 elettrone (da +2 è passato a +3)
Ricordiamoci che il n.o. deve essere moltiplicato per l’indice e per il coefficiente stechiometrico della specie chimica. Siccome abbiamo Cr2 tra i reagenti e 2Cr tra i prodotti, i loro n.o. sono rispettivamente +6 moltiplicato per l’indice 2 (cioè +12) e +3 per il coefficiente stechiometrico 2 (cioè +6).
Sommiamo ora questi elettroni alle rispettive semireazioni, bilanciando così la carica sia della riduzione sia dell’ossidazione (nella riduzione gli elettroni devono essere sommati a sinistra, mentre nell’ossidazione devono essere sommati a destra):
Cr2O72- + 14H+ + 6e– → 2Cr3+ + 7H2O
Fe2+ → Fe3+ + e–
Terminati questi passaggi, bilanciamo il numero di elettroni acquistati e ceduti.
Dato che in qualsiasi reazione redox il numero di elettroni acquistati è sempre uguale al numero di elettroni ceduti, dobbiamo fare in modo che Fe, che ha ceduto 1 elettrone, ne ceda 6, cioè tanti quanti quelli acquistati da Cr.
Per farlo, riduciamo ai minimi termini 6 e 1, moltiplicando poi per ciascun risultato la reazione della specie chimica opposta:
\frac{6}{1}=6\frac{1}{1}=1Moltiplichiamo quindi per 6 la semireazione di ossidazione e per 1 la semireazione di riduzione:
Cr2O72- + 14H+ + 6e– → 2Cr3+ + 7H2O
6Fe2+ → 6Fe3+ + 6e–
A questo punto uniamo le due semireazioni (semplificando le specie chimiche uguali):
Cr2O72- + 14H+ + 6Fe2+ → 2Cr3+ + 7H2O + 6Fe3+
Controlliamo tutte le altre specie chimiche e, se ce n’è bisogno, le bilanciamo (qui va già tutto bene, per cui non dobbiamo fare alcuna aggiunta).
Se la reazione redox avviene in una soluzione acquosa acida, il bilanciamento è terminato.
Se invece la reazione redox avviene in una soluzione acquosa basica, per il suo corretto bilanciamento bisogna contare gli ioni H+ e aggiungere lo stesso numero di ioni OH– sia a sinistra sia a destra della freccia (in pratica, trasformiamo gli ioni H+ in molecole di H2O nella parte in cui ci sono ioni H+, mentre aggiungiamo ioni OH– nell’altra parte).
Attenzione
Ricordiamoci che nelle reazioni redox la specie chimica che si ossida è anche chiamata agente riducente, perché provoca la riduzione dell’altra, mentre la specie chimica che si riduce è anche chiamata agente ossidante, perché provoca l’ossidazione dell’altra.
