La curva di riscaldamento di una sostanza pura
Che cos’è la curva di riscaldamento di una sostanza pura? Vediamolo insieme.
Se aumentiamo la temperatura di una sostanza, tale sostanza a un certo punto passa da uno stato di aggregazione a un altro.
Per rappresentare con più precisione questo processo, si usa la cosiddetta curva di riscaldamento, cioè un grafico che mostra l’aumento della temperatura della sostanza durante il riscaldamento in relazione al tempo trascorso (in altre parole, un grafico che ci dice a quanto corrisponde la temperatura della sostanza dopo che è stata riscaldata per un certo tempo).
Come si ottiene la curva di riscaldamento di una sostanza?
Per ottenere la curva di riscaldamento di una sostanza, si prende la sostanza allo stato solido, la si riscalda e, quando si verifica il passaggio da uno stato a un altro, si registrano sia la temperatura sia il tempo trascorso.
La curva di riscaldamento consente di individuare il punto di fusione e il punto di ebollizione di una sostanza, cioè la temperatura a cui essa diventa rispettivamente liquida e aeriforme.
Le soste termiche
Quando la sostanza raggiunge il punto di fusione o il punto di ebollizione, la sua temperatura smette momentaneamente di aumentare, anche se continuiamo a riscaldarla.
Infatti, la temperatura di una sostanza aumenta solo quando la sostanza è monofasica, cioè quando è completamente solida, liquida o aeriforme.
Dato che qualsiasi sostanza passa da uno stato all’altro in maniera graduale e non all’improvviso, c’è inevitabilmente un momento in cui la sostanza è a metà tra uno stato e un altro (ad esempio, un po’ solida e un po’ liquida) e in quel momento la sua temperatura non aumenta. Non appena la sostanza ha cambiato completamente stato, la sua temperatura torna ad aumentare.
Questi intervalli temporali in cui la temperatura di una sostanza rimane costante (nonostante la sostanza venga riscaldata) prendono il nome di soste termiche. Il calore fornito durante le soste termiche viene definito calore latente.
Nella curva di riscaldamento di qualsiasi sostanza le soste termiche sono in tutto due, una in corrispondenza del punto di fusione (cioè quando la sostanza passa da solida a liquida) e una in corrispondenza del punto di ebollizione (cioè quando la sostanza passa da liquida ad aeriforme).
È importante ricordarsi che la sosta termica di ebollizione è sempre maggiore della sosta termica di fusione, perché per rendere aeriforme una sostanza serve più energia di quanta ne serva per renderla liquida.
La curva di riscaldamento dell’acqua
Questa ad esempio è la curva di riscaldamento dell’acqua (formula chimica H2O):
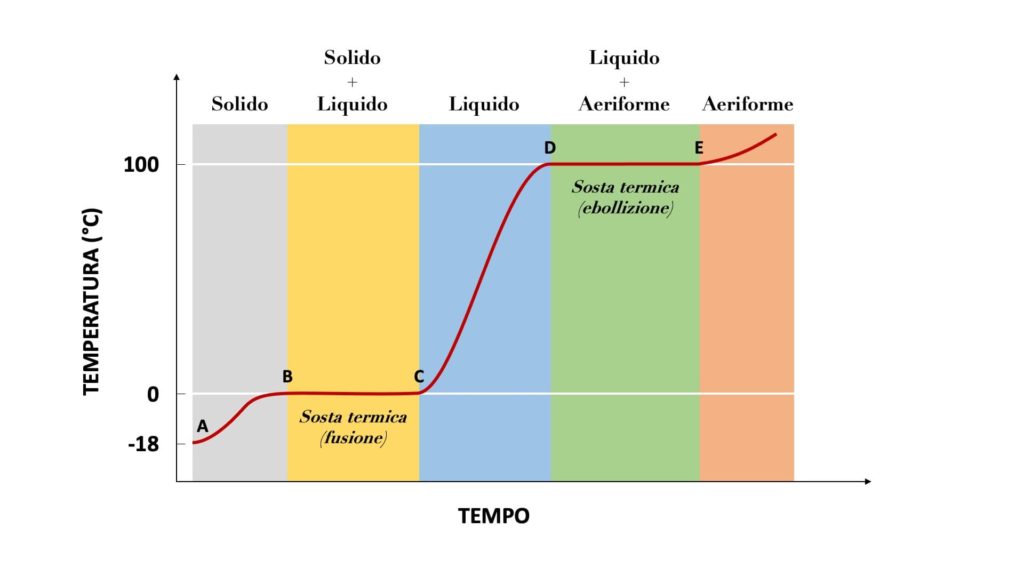
Dove:
| A | = | Temperatura di partenza |
| B | = | Punto di fusione |
| B-C | = | Sosta termica (fusione) |
| D | = | Punto di ebollizione |
| D-E | = | Sosta termica (ebollizione) |
Fino a 0°C, cioè fino al punto di fusione, l’acqua rimane completamente solida. Non appena viene raggiunta questa temperatura, ha inizio la prima sosta termica e la temperatura smette di aumentare, dato che l’acqua è in parte solida e in parte liquida.
Una volta che l’acqua è diventata del tutto liquida, la sosta termica finisce e la temperatura torna ad aumentare, finché raggiunge 100°, cioè il punto di evaporazione. Ha quindi inizio la seconda sosta termica, che dura fino al completo raggiungimento dello stato aeriforme da parte dell’acqua.
Attenzione
Quando si realizza una curva di riscaldamento, si assume che la pressione (cioè l’altro fattore che insieme alla temperatura determina il passaggio da uno stato a un altro) sia costante.
Se così non fosse, la sostanza non cambierebbe solo per la variazione di temperatura, ma anche per la variazione di pressione (tuttavia, dato che con la curva di riscaldamento stiamo analizzando la temperatura, non ci interessa prendere in considerazione anche quest’altro fattore).
Nella curva di riscaldamento dell’acqua si assume ad esempio che la pressione corrisponda ad 1 atm.
Ricordiamoci infine che, se leggiamo al contrario una qualsiasi curva di riscaldamento (cioè dallo stato aeriforme allo stato solido), otteniamo la curva di raffreddamento di una sostanza.
