Punto critico, stato supercritico e fluidi supercritici
Per capire bene il punto critico, lo stato supercritico e i fluidi supercritici, conviene ripassare brevemente gli stati di aggregazione della materia e i passaggi di stato.
La materia può presentarsi allo stato solido, liquido o aeriforme e può passare da uno stato a un altro, trasformandosi ad esempio da solida a liquida. I due fattori che determinano queste trasformazioni sono la temperatura e la pressione.
Temperatura e pressione
Più la temperatura aumenta, più le particelle della materia si muovono liberamente (perché aumenta la loro energia cinetica):
SE AUMENTA LA TEMPERATURA
Solido → Liquido → Aeriforme
Più la pressione aumenta, meno le particelle della materia si muovono liberamente (perché diminuisce lo spazio in cui possono muoversi):
SE AUMENTA LA PRESSIONE
Aeriforme → Liquido → Solido
Temperatura critica, pressione critica e punto critico
Se però aumentano sia la temperatura sia la pressione (e quindi le particelle si muovono sempre di più, ma hanno sempre meno spazio per muoversi), che cosa succede? La materia a un certo punto raggiunge la cosiddetta temperatura critica e la cosiddetta pressione critica:
- la temperatura critica è la temperatura oltre la quale, anche se aumenta la pressione, la materia rimane allo stato aeriforme e non passa allo stato liquido
- la pressione critica è la pressione oltre la quale, anche se aumenta la temperatura, la materia rimane allo stato liquido e non passa allo stato aeriforme
Questa coppia di valori costituisce il punto critico, oltre il quale la materia entra nello stato supercritico e diventa un fluido supercritico, cioè una sostanza che ha proprietà in parte simili a quelle di un liquido e in parte simili a quelle di un aeriforme (le particelle di un fluido supercritico sono infatti vicine le une alle altre come nei liquidi per effetto della pressione, ma riescono comunque a muoversi come negli aeriformi per effetto della temperatura).
Punto critico e diagramma di stato
I livelli di temperatura e di pressione a cui corrispondono i vari stati di aggregazione di una sostanza (incluso il punto critico) sono rappresentati graficamente attraverso i diagrammi di stato:
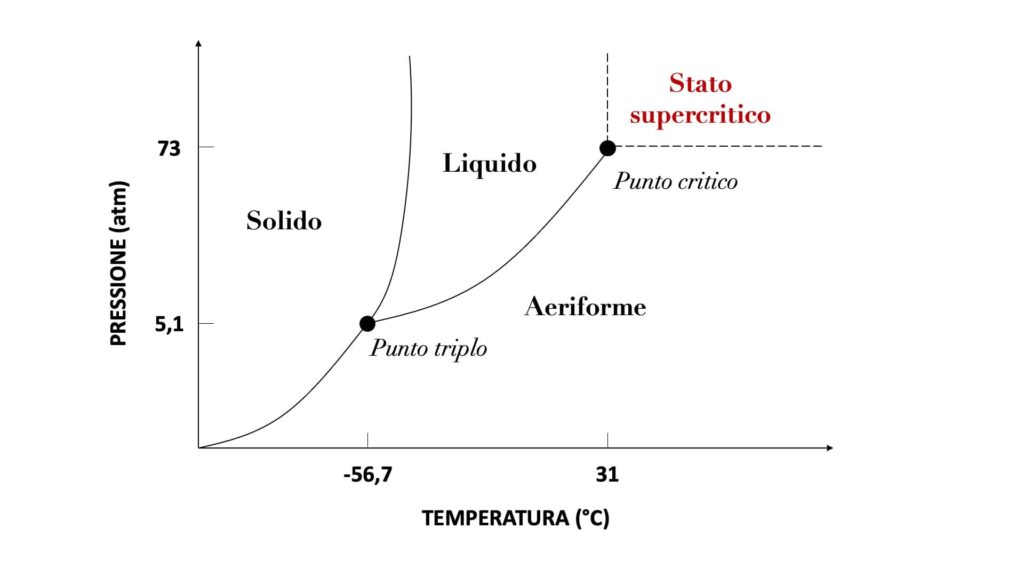
Qui ad esempio abbiamo il diagramma di stato dell’anidride carbonica (formula chimica CO2).
Come possiamo vedere, la temperatura critica è a 31°, mentre la pressione critica è a 73 atm. Se vengono superati questi valori, che rappresentano il punto critico, l’anidride carbonica entra nello stato supercritico, diventando di conseguenza un fluido supercritico.
Per il resto, il diagramma ci mostra in che stato si trova la sostanza a una determinata temperatura e a una determinata pressione, indicandoci inoltre il suo punto triplo (cioè la temperatura e la pressione a cui la sostanza si presenta contemporaneamente allo stato solido, liquido e aeriforme).
Elenco dei punti critici
Ecco i punti critici (cioè temperatura critica e pressione critica) delle principali sostanze:
| Sostanza | Temperatura critica (°C) | Pressione critica (atm) |
| Acido solforico | 654 °C | 45,4 atm |
| Acqua | 374,1 °C | 218,3 atm |
| Ammoniaca | 132,4 °C | 111,3 atm |
| Anidride carbonica | 31,04 °C | 72,8 atm |
| Argon | -122,4 °C | 48,1 atm |
| Azoto | -149,6 °C | 33,5 atm |
| Bromo | 310,8 °C | 102 atm |
| Cesio | 1664,85 °C | 94 atm |
| Cloro | 143,8 °C | 94 atm |
| Elio | -267,96 °C | 2,24 atm |
| Etanolo | 241°C | 62,18 atm |
| Fluoro | -128,85 °C | 51,5 atm |
| Idrogeno | -239,95 °C | 12,8 atm |
| Cripton | -63,8 °C | 54,3 atm |
| Litio | 2950 °C | 652 atm |
| Mercurio | 1476,9 °C | 1720 atm |
| Metano | -82,3 °C | 45,79 atm |
| Neon | -228,75 °C | 27,2 atm |
| Oro | 6977 °C | 5000 atm |
| Ossigeno | -118,6 °C | 49,8 atm |
| Xeno | 16,6 °C | 57,6 atm |
| Zolfo | 1040,85 °C | 207 atm |
