Diagramma di stato
Un diagramma di stato è un grafico che mostra le condizioni di temperatura e di pressione a cui corrispondono i vari stati di aggregazione di una sostanza.
In altre parole, è un grafico che ci dice in quale stato si trova una sostanza a una determinata temperatura e a una determinata pressione.
Un esempio di diagramma di stato
Ecco ad esempio il diagramma di stato dell’anidride carbonica (formula chimica CO2):
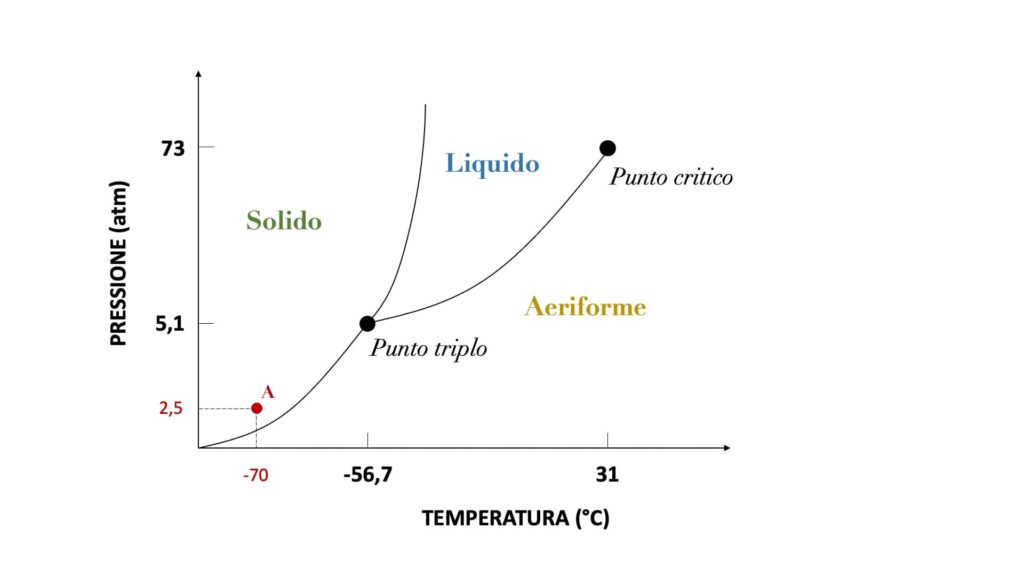
Come possiamo notare, ogni diagramma è suddiviso in tre aree, una per ciascuno stato.
Sapendo che una sostanza si trova a una certa temperatura e a una certa pressione, possiamo conoscere il suo stato intersecando queste due misure e osservando in quale area ricade il punto di intersezione.
Ad esempio, se l’anidride carbonica avesse una temperatura di -70° e una pressione di 2,5 atm, si troverebbe allo stato solido, dato che il punto di intersezione di questi due valori ricadrebbe nell’area dello stato solido (punto A del precedente grafico).
Le curve nel diagramma di stato
Le curve che separano le tre aree rappresentano le condizioni di temperatura e di pressione a cui avvengono i passaggi di stato. In altre parole, se queste curve vengono superate, la sostanza passa da uno stato a un altro.
Se invece la temperatura e la pressione della sostanza si intersecassero su una curva, la sostanza sarebbe in equilibrio tra due stati, cioè si troverebbe in parte in uno stato e in parte in un altro (ad esempio, un po’ solida e un po’ liquida):
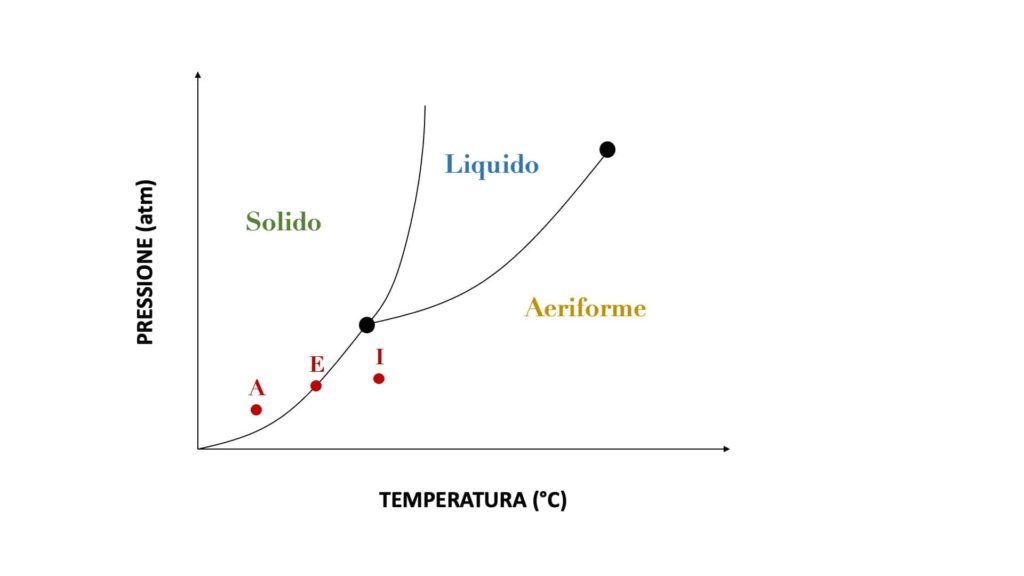
Facciamo un esempio pratico:
- se il punto di intersezione tra temperatura e pressione ricade nell’area dello stato solido (punto A), la sostanza è solida
- se il punto di intersezione tra temperatura e pressione ricade nell’area dello stato aeriforme (punto I), la sostanza è aeriforme
- se il punto di intersezione tra temperatura e pressione ricade su una curva (punto E), la sostanza è in equilibrio tra i due stati divisi da tale curva (è quindi in parte solida e in parte aeriforme in questo caso)
Punto triplo e punto critico
Il punto in cui le curve si incontrano prende il nome di punto triplo e rappresenta l’unico momento in cui i tre stati della sostanza coesistono. In altre parole, alle condizioni di temperatura e di pressione di questo punto la sostanza è contemporaneamente solida, liquida e aeriforme.
Ad esempio, nel diagramma dell’anidride carbonica il punto triplo è individuato da una temperatura di -56,7° e da una pressione di 5,1 atm.
In fondo alla curva che divide lo stato liquido dallo stato aeriforme c’è invece il punto critico, cioè la temperatura e la pressione oltre le quali la sostanza diventa un fluido supercritico, assumendo proprietà in parte simili a quelle di un liquido e in parte simili a quelle di un aeriforme (le particelle di un fluido supercritico sono infatti vicine le une alle altre come nei liquidi per effetto della pressione, ma riescono comunque a muoversi come negli aeriformi per effetto della temperatura).
Ad esempio, nel diagramma dell’anidride carbonica il punto critico è individuato da una temperatura di 31° e da una pressione di 73 atm.
Attenzione
I diagrammi di stato vengono chiamati anche diagrammi di fase, dato che ci permettono di sapere da quante fasi fisiche è costituita una sostanza.
Se infatti la sostanza si trova in un unico stato (ad esempio, è del tutto solida), presenta un’unica fase. Se invece la sostanza si trova in equilibrio tra due stati (ad esempio, è in parte liquida e in parte aeriforme), presenta due fasi.
Pertanto, nei diagrammi di stato i punti di intersezione che non sono sulle curve (e che quindi si trovano nell’area di un preciso stato) indicano che la sostanza è costituita da un’unica fase, mentre i punti di intersezione che sono sulle curve (e che quindi si trovano tra due stati) indicano che la sostanza è costituita da due fasi.
