I gas ideali (schema generale)
Che cosa sono i gas ideali? Vediamolo insieme.
Oggi sappiamo che i gas si comportano secondo determinate leggi, note come leggi dei gas. Ma come sono state scoperte queste leggi? È stato preso un gas ed è stato studiato il comportamento di tutte le sue particelle?
Ovviamente no, non solo perché sarebbe impossibile analizzarle a una a una a causa del loro numero elevatissimo, ma anche perché per ciascun gas la natura chimica delle particelle è diversa.
La risposta è che per formulare queste leggi non è stato usato un gas reale, cioè un gas effettivamente presente in natura, ma un modello teorico che potesse poi essere applicato a tutti i gas.
Questo modello teorico prende il nome di gas ideale (o gas perfetto).
Le caratteristiche dei gas ideali
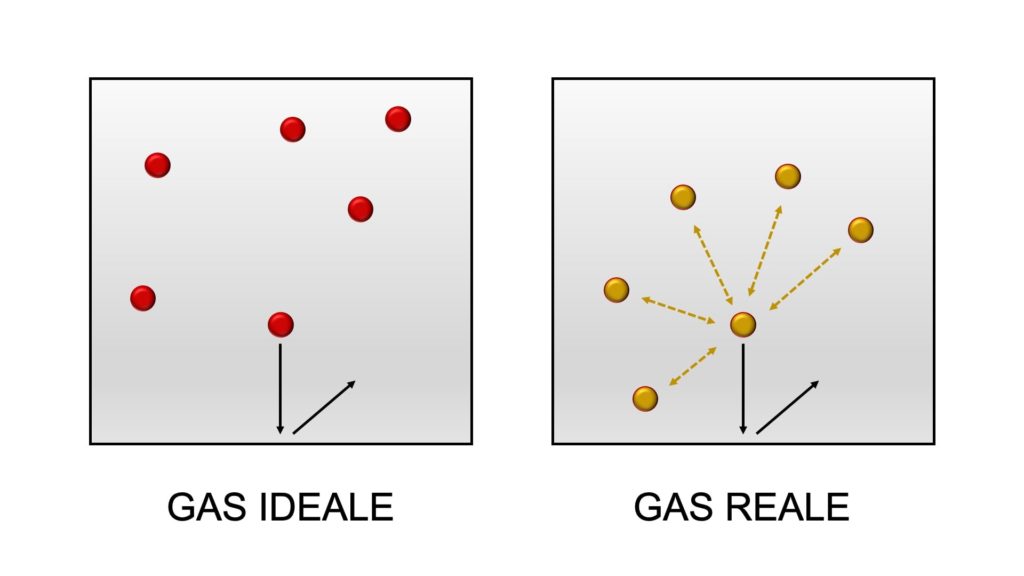
Un gas ideale è quindi un gas immaginario che presenta le seguenti caratteristiche:
- le sue particelle sono puntiformi: il volume delle particelle è trascurabile rispetto al volume del gas
- le forze attrattive tra le sue particelle sono nulle: le particelle non si attraggono né si respingono a vicenda
- il moto delle sue particelle è disordinato e omnidirezionale: le particelle si muovono disordinatamente e in ogni direzione
- gli urti tra le sue particelle o tra le sue particelle e le pareti del recipiente in cui si trova il gas sono elastici: quando le particelle si urtano tra loro o urtano le pareti del recipiente, non c’è alcuna dispersione di energia cinetica
Prendere in considerazione un gas ideale invece che un gas reale permette quindi di trascurare la natura chimica delle particelle e di formulare così delle leggi che possano poi valere per tutti i gas.
La teoria che spiega il comportamento di un gas in base al modello dei gas ideali è la teoria cinetico-molecolare, secondo cui il comportamento di un gas dipende dal comportamento delle sue particelle.
A partire da questa teoria sono state poi formulate le leggi dei gas, che sono le seguenti:
Attenzione
Quando la temperatura è sufficientemente alta e la pressione sufficientemente bassa da rendere trascurabili il volume delle particelle e la loro forza attrattiva, i gas reali hanno un comportamento simile a quello dei gas ideali.
