Reazioni redox (ossido-riduzione)
Le reazioni redox, chiamate anche reazioni di ossido-riduzione, sono reazioni chimiche in cui avviene un trasferimento di elettroni da una specie chimica a un’altra:
- la specie chimica che cede elettroni subisce un’ossidazione, cioè il suo numero di ossidazione aumenta
- la specie chimica che acquista elettroni subisce una riduzione, cioè il suo numero di ossidazione diminuisce
Facciamo un esempio:
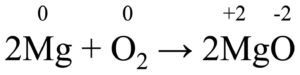
Qui il magnesio reagisce con l’ossigeno e produce ossido di magnesio.
Come possiamo notare, sia il magnesio sia l’ossigeno hanno inizialmente n.o. 0, ma dopo la trasformazione in ossido di magnesio il loro n.o. diventa rispettivamente +2 e -2.
In altre parole, il magnesio si è ossidato, cioè ha ceduto elettroni, mentre l’ossigeno si è ridotto, cioè ha acquistato elettroni.
La specie chimica che si ossida è anche chiamata agente riducente, perché provoca la riduzione dell’altra, mentre la specie chimica che si riduce è anche chiamata agente ossidante, perché provoca l’ossidazione dell’altra.
Come si riconosce una reazione redox?
Le reazioni redox sono facili da riconoscere, perché comportano sempre una variazione del numero di ossidazione delle specie chimiche coinvolte.
Pertanto, quando ci troviamo di fronte a una qualsiasi reazione, non dobbiamo fare altro che attribuire il giusto numero di ossidazione a tutte le specie chimiche che compaiono nella reazione e verificare poi se i numeri di ossidazione cambino o restino come prima (se cambiano, siamo di fronte a una reazione redox).
Ad esempio:
2Cl2 + 3O2 → 2Cl2O3
Seguiamo le regole per l’assegnazione del numero di ossidazione, in modo da ricavare i numeri di ossidazione di ciascun elemento presente:
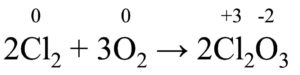
Come possiamo notare, c’è una variazione dei numeri di ossidazione (il cloro passa da 0 a +3, mentre l’ossigeno passa da 0 a -2), per cui ci troviamo di fronte a una reazione redox.
Reazione non redox
Osserviamo ora questa reazione:
HCl + NaOH→ H2O + NaCl
Usando le stesse regole di prima, ricaviamo i seguenti numeri di ossidazione:
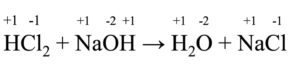
Dato che tutti gli elementi presenti conservano lo stesso numero di ossidazione, non ci troviamo di fronte a una reazione redox.
Il numero complessivo di elettroni nelle reazioni redox
Nelle reazioni redox il numero di elettroni ceduti è sempre uguale al numero di elettroni acquisiti.
Ad esempio, quando l’idrogeno e il cloro reagiscono e producono acido cloridrico, l’idrogeno cede un elettrone e il cloro acquista un elettrone.
Come si bilanciano le reazioni redox?
È importante ricordarsi che le reazioni redox possono essere bilanciate in due modi:
